Jakoś tak jest (zupełnie przypadkowo, hehe), że wdrożenie na szeroką skalę przydatnego badania molekularnego odbywa się wówczas, gdy pojawia się na daną chorobę leczenie celowane.
Tak tez było z przeżywającą obecnie renesans metodą oceny „hipermutacji somatycznej łańcuchów ciężkich immunoglobulin” w przewlekłej białaczce limfocytowej. Trudna nazwa? No to skróćmy ją sobie do ”oceny stanu zmutowania IGHV”, a jeszcze krócej do SHM (od Somatic HyperMutation). Jest to bardzo ciekawe badanie, a nawet ciekawsza jest fizjologia procesu rearanżacji immunoglobulin w limfocytach, której pokłosiem jest „zmutowanie” łańcuchów.
Użyłam słowa „ciekawa”? Miałam na myśli „hardcorowa”…
Na wstępie disclaimer: jeżeli chcielibyście zacząć rozumieć układ immunologiczny, to polecam książkę „Odporność„. „Immuno” jako całość to temat niewytłumaczalny, więc nawet się nie silę, żeby próbować.
My jedynie, jak w okularze mikroskopu, zawęzimy sobie pole widzenia do jednego, malusieńkiego elementu tej gigantycznej maszyny. Do prawidłowego i nowotworowego limfocyta B i jego prekursorów. I tylko i wyłącznie w kontekście immunoglobulin, które one produkują.
Zacznijmy ab ovo od samego białka immunoglobuliny. Zbudowane jest ono z dwóch łańcuchów ciężkich i dwóch lekkich. To chyba wiedzą wszyscy, którzy tu zaglądają.
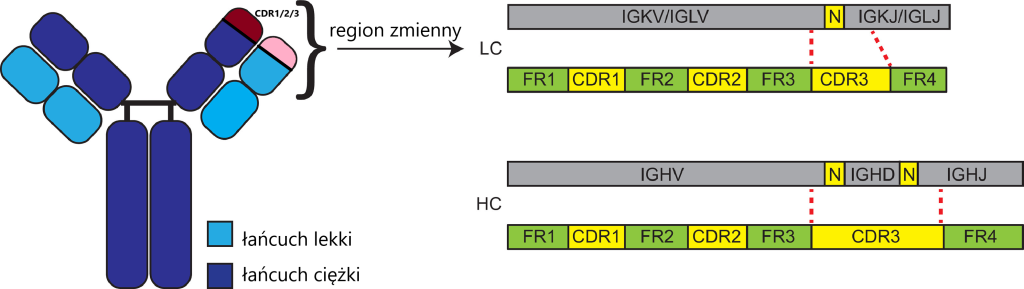
Rycina: Struktura immunoglobuliny. Zaznaczono najważniejszy dla wiązania antygenu region, ukształtowany z części zmiennej oraz elementów kodowanych przez regiony CDR, które stykają się z antygenami.Za: Hengeveld i wsp, https://doi.org/10.1016/j.exphem.2020.09.194 (zmodyfikowany).
Łańcuchy przeciwciał zorganizowane są w pewne domeny funkcjonalne. Część stała C (constant), koduje fragment kotwiczący przeciwciało w błonie i determinuje czas „życia” przeciwciała. Rodzaj łańcucha C jest inny dla klasy M, D, E, A czy G. Domena łącząca J (joining) pozwalający na oligomeryzację przeciwciał klas M i A. Domena różnorodności D (diversity) łączy łańcuchy V i J czymś w rodzaju przegubu o różnej długości. Jej sekwencja ma największy wpływ na zmienność, ponieważ w niej rezyduje większość domeny CDR3, ulegającej największej hipermutacji i zmianom długości w procesie rekombinacji. No a region V (variable), jak sama nazwa wskazuje – jest zmienny. Po pierwsze różnych regionów zmiennych jest najwięcej w genomie, a dodatkowo zawierają ulegające hipermutacji segmenty CDR1 i CDR2.
Region zmienny (V) i różnorodny (oraz mały fragment sekwencji J), są zaangażowane w rozpoznawanie antygenu, to znaczy- aminokwasy tam kodowane są eksponowane na koniuszku immunoglobuliny. Te fragmenty ochrzczono mianem „CDR” (complementarity determining regions), czyli „regionów warunkujących komplementaność”. Do nich wrócimy na samym końcu tekstu.
Wytwarzanie przeciwciał zaczyna się w komórkach pro-B, czyli gdzieś na obrzeżach szpiku kostnego, przy endosteum. Tam, po serii podziałów komórek macierzystych zaczyna różnicować się linia B. Pierwszym tego zwiastunem jest ekspresja odpowiednich antygenów powierzchniowych (o których tez mówić nie będziemy) i zapoczątkowanie serii chirurgicznych cięć i szyć w genomie komórki pro-B.
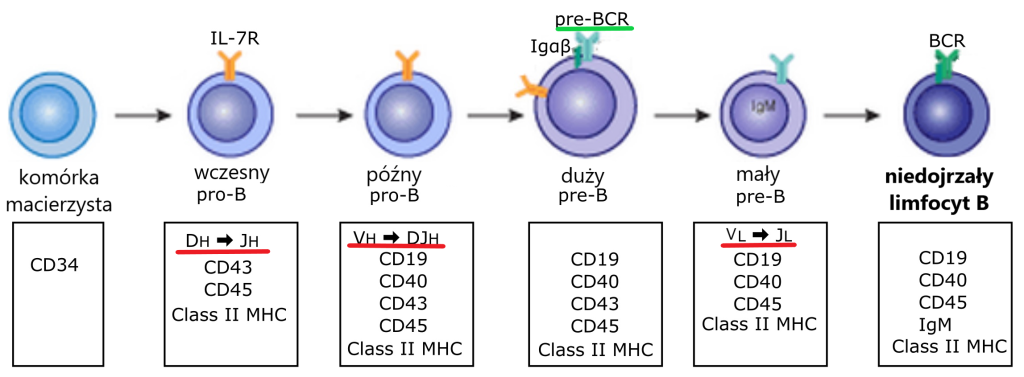
Rycina: Rozwój linii B – podkreślono momenty składania kaset genowych dla łańcuchów ciężkich i lekkich (kolor czerwony) oraz „testowy” receptor pre-BCR (kolor zielony). Oryginalny obraz by BobologistVectorization by Mikael Häggström, M.D. Author info – NoneMikael Häggström, M.D., zmodyfokowano: Marzena Wjtaszewska. CC BY-SA 4.0 https://creativecommons.org/licenses/by-sa/4.0, via Wikimedia Commons
Spójrzmy, jak wygląda dystalny fragment chromosomu 14, zaraz za telomerem. Rezydują na nim jak na sznurku, nanizane różne warianty segmentów V , D, J oraz C immunoglobuliny V.
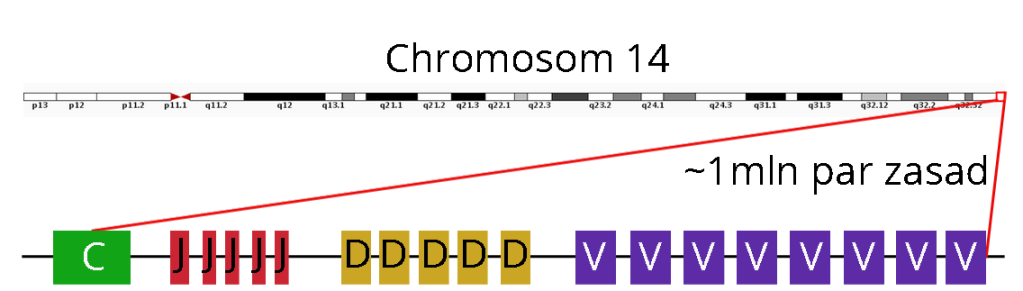
Tak wygląda mapa chromosomu w komórkach innych niż limfocyty. Wielka na milion par zasad kaseta genowa jest w nich nietknięta. Trochę podobnie wygląda region IGL (nie posiada genów D) na chromosomie 22, ale nim w sumie się zajmować nie będziemy.
Wszystkie te koraliki na sznurku, należące do danej grupy V, D lub J, to takie klocki lego, które można niemal dowolnie składać. Poprawne złożenie ze sobą (w ramce odczytu) odpowiednich fragmentów V-D-J, oraz regionu stałego C daje nam funkcjonalny łańcuch ciężki, który może połączyć się z funkcjonalnym łańcuchem lekkim (albo jego surogatem, o czym dalej). Składanie ze sobą klocków łańcucha lekkiego trwa w rozwoju limfocytu później, na etapie małego prekursora pre-B.
Aby złożyć ze sobą klocki łańcucha ciężkiego, komórka pro-B angażuje bardzo niebezpieczne narzędzie: rekombinację DNA. W omawianym przypadku maszyneria naprawy DNA w zasadzie… psuje je, doprowadzając do dwuniciowych pęknięć w obrębie locus IGHV. Oczywiście, proces jest ściśle regulowany – pomiędzy segmentami ulegającymi rekombinacji znajdują się specjalne przekładki, tzw. RSS (recombination signal sequence). One to nakierowują molekularny skalpel do precyzyjnego cięcia, choć zdarza się że ów skalpel się omsknie (wtedy możemy dostać np. ostrej białaczki lub chłoniaka). Nasz sklapel – rekombinaza (podejrzanie przypominająca transpozazę) składa ze sobą przypadkowy fragment D i J, wycinając po prostu spomiędzy nich wszystko co tam się znajdowało. Nici łączy mechanizm naprawy DNA typu NHEJ, (non-homologous end joining). Po tym zabiegu nasza komórka pro-B poddaje się kolejnemu zabiegowi cięcia. Tym razem wycinany jest na odlew fragment pomiędzy segmentem V a gotowym segmentem DJ.
I gotowe!
…
Gotowe?
…
…
No nie.
Może się zdarzyć – i zdarza się- że proces rekombinacji zajdzie krzywo. Nie powstanie immunoglobulina, gdzieś coś przesunie się w ramce i nie dojdzie do poprawnej produkcji białka. Tak rzeczywiście się dzieje, prawdopodobnie w ponad 1/3 przypadków.
Muszę wspomnieć, że nieudany limfocyt B, który nie potrafi zrobić funkcjonalnego przeciwciała, popełnia apoptozę. Straszne marnotrawstwo.
Ewolucja doszła do tego samego wniosku! Oto p’sze państwa: wynalazca recyklingu! Była pierwsza przed Unią Europejską i żulami z Mokotowa!
Ehem. No więc limfocyt, któremu nie udało się stworzyć funkcjonalnej immunoglobuliny, wraca do początku procesu. Bierze w obroty homologiczny chromosom 14, do tej pory nietknięty skalpelem. (Musimy przecież pamiętać, że jesteśmy organizmami diploidalnymi, więc mamy DWA chromosomy 14 i DWA pełne zestawy segmentów V D i J dla immunoglobulin!). Gdy i ta próba się nie powiedzie- komórkę pro-B czeka niebyt. Gdy jednak się uda, dojrzały limfocyt odziedziczy piętno w postaci dwóch sekwencji łańcucha dla immunoglobuliny- przy czym tylko z jednego powstaje białko.
Pozostaje jeszcze jeden szczegół: w jaki sposób komórka prekursorowa może przetestować, czy łańcuch V jest sprawny? Przecież nie złożyła jeszcze łańcucha L??? I tu natura po raz kolejny zadziwia – w zanadrzu ma specjalny „testowy” łańcuch L, nazwany SLC (surrogate light chain). Jeśli połączy się on z łańcuchem V, to jest on sprawny i rozwój komórki (teraz już pre-B) zachodzi dalej.
Opisany fenomen rearanżacji łańcucha dwa razy nosi miano „ekskluzji allelicznej„. Temat wróci jak bumerang przy omawianiu badania mutacji.
Gdy złożeniu zusammen do kupy ulegnie już V, to samo dzieje się (choć skromniej) w łańcuchu L. Z komórki pre-B powstaje niedojrzały limfocyt B, który ze szpiku kostnego wędruje do grudki chłonnej. Szkoli się w niej z odróżniania swoich od obcych. Jeśli przeciwciało rozpoznaje „za bardzo” nasz organizm, to komórka jest zabijana. Jeśli przeciwciało to bubel i nic nie rozpoznaje, też jest zabijana.
Po szkoleniu limfocyt myśli, że jest taki ważny, bo produkuje poprawną immunoglobulinę M! (o łańcuchach stałych rozmawiać nie będziemy, ale one też rekombinują, by dać nam poza IgM także IgA, IgD, IgG lub E)…
…I co z tego droga komórko B, skoro twoja immunoglobulina jest słaba, stereotypowa, i nudna? Jakbyśmy mieli tylko takie, to zabiłby nas katar.
Rekombinacja to dopiero początek. Daje nam zmienność rzędu kilkuset tysięcy różnych przeciwciał. A my potrzebujemy ich tylu co gwiazd w drodze mlecznej.
Dlatego limfocyt na tym nie poprzestaje. Podróżuje sobie po układzie limfatycznym i ma przygody. W grudce, poza strojeniem się w nowe antygenowe szaty, nasz limfocyt napotyka obce antygeny! I co robi? No wiadomo, mutuje!
No i w końcu dochodzimy do clue opowieści. Limfocyt dojrzewa do swojej roli. W wyciętych segmentach immunoglobuliny dochodzi do HIPERMUTACJI SOMATYCZNEJ.
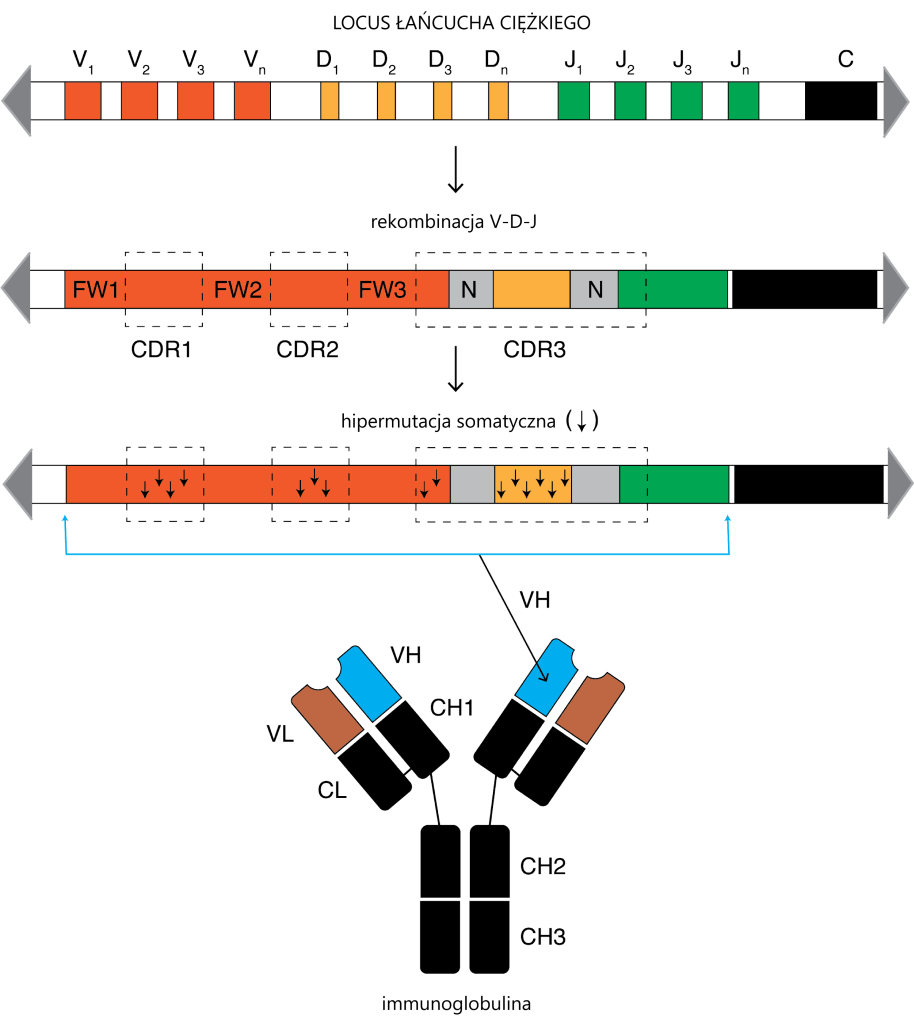
Za: Rashedul Islam Rony, CC BY-SA 4.0 https://creativecommons.org/licenses/by-sa/4.0, via Wikimedia Commons
Cóż to takiego? Otóż w ograniczonych i ściśle określonych loci IGH i i IGL dochodzi do masywnego „psucia” genomu poprzez wprowadzanie weń substytucji. Białko odpowiedzialne za ten proces nazywa się AID i kojarzy mi się z kulą na łańcuchu z Mario Brosa (Gdy AID zerwie się z łańcucha, może być sprawcą onkogenezy). AID odpowiada za unikatowość immunoglobuliny. Małe mutacje sprawiają, że jest ona doskonale dopasowana do antygenu i jedyna w swoim rodzaju. Tak powstaje mrowie różnych immunoglobulin – każda produkowana przez inny limfocyt. Sekwencja DNA takiego „unikalnego” limfocytu nazywana jest „klonotypem”.
*To jest moment kluczowy nie tylko w odporności swoistej, ale także w przewlekłej białaczce limfocytowej.*
W latach 90′ zauważono, że jeśli limfocyt białaczkowy, przeszedł hipermutację somatyczną, czyli spotkał się z antygenem i został aktywowany, to jest potulny jak baranek i chemioterapia zwykle mu szkodzi, gdy zaś do tego procesu nie doszło, to jest wkurzonym frustratem, odpornym na leczenie. Stąd oznaczenie statusu zmutowania pozwalało na oszacowanie, czy białaczka (lub chłoniak) wywodząca się z dojrzałego limfocytu (CLL/SLL) będzie indolentna, czy agresywna. Ma to sens- zwykle komórki bardziej zbliżone do pierwotnych, macierzystych i niedojrzałych są bardziej agresywne niż te zróżnicowane, zbliżone fenotypowo do dojrzałej.
Co z tą informacją można było zrobić? Do niedawna nic, natomiast od momentu pojawienia się nowoczesnych terapii CLL- całkiem sporo. Można zdecydować o wyborze bardziej efektywnego leczenia lub o podjęciu wcześniejszej interwencji terapeutycznej! Dlatego właśnie oznaczenie SHM nagle stało się istotne.
| W praktyce status zmutowania oznacza się tylko w IGHV. Po zsekwencjowaniu odpowiednio długiego łańcucha (NGS lub Sangerem) porównuje się sekwencję ze zdeponowanymi w bazie danych IMGT wzorcowymi sekwencjami germinalnymi. Jeśli identyczność sekwencji jest powyżej 98% mamy do czynienia z łańcuchem niezmutowanym, a jeżeli poniżej- zmutowanym. Proces sekwencjonowania jest trudny metodologicznie z powodu zmienności łańcuchów oraz ekskluzji allelicznej. Jeśli napotykamy 2 łańcuchy, to w sekwenogramie Sangera nakładać nam się będą 2 sekwencje, które ciężko rozdzielić. Stąd coraz popularniejsza staje się, choć nie jest pozbawiona wad metoda NGS. |
Jest jeszcze jedna ogromnie ciekawa obserwacja, dotycząca immunoglobulin białaczkowych. Logika podpowiada, że jeśli składanie łańcuchów immunoglobulin i ich mutowanie jest procesem przypadkowym, to każda białaczka powinna posiadać unikalny łańcuch (lub 2- patrz ekskluzja alleliczna). Statystycznie po równo powinno być białaczek z każdym klonotypem V/D/J. Tak się jednak nie dzieje.
Z jakiegoś powodu pewne łańcuchy pojawiają się bardzo często i to z konkretną sekwencją aminokwasów w regionach CDR. Dla przykładu: łańcuch V1-69 pojawia się w ok. 10% przypadków CLL, do tego ZAWSZE jest niezmutowany. Z kolei równie częsty łańcuch V3-21 niemal zawsze jest zmutowany, co więcej ma specyficzną konstelację mutacji!
Taki fenomen nazwano z kolei „stereotypią” . Stereotypowe łańcuchy o określonych sekwencjach aminokwasowych we fragmencie CDR3 zebrano w tzw. „subsety”, z których część warunkuje agresywny lub indoletny przebieg terapii bez względu na sam status hipermutacji. Dla przykładu- limfocyt białaczkowy posiadający zmutowany łańcuch V3-21, który posiada specyficzny zestaw mutacji w CDR3, tzw. subset #2, jest bardzo źle rokujący (pomimo że przecież jest zmutowany!). Subset #8 towarzyszący IGHV4-39 z kolei jest niezmutowany i związany z wysokim ryzykiem transformacji do agresywnego chłoniaka, tzw. zespołu Richtera.
Czyli: subset to w skrócie sekwencja aminokwasowa kodowana przez CDR3, w której powtarzają się aminokwasy takie same lub o zbliżonych właściwościach (np kwaśne, zasadowe, hydroforowe, polarne itd). Żeby taki subset znaleźć potrzebny jest więc specjalny algorytm bioinformatyczny, który przeprowadzi in silico translację, alignment, analizę kolejności i podobieństwa aminokwasów w CDR3. Coś takiego zrobili za nas badacze IGHV z jaskini nietoperza (sic! to jest skrót od Bioinformatics Analysis Team), a my możemy porównać nasz łańcuch IGHV z wygenerowanymi subsetami w programie Arrest/AssignSubsets. Pełen wykaz subsetów z opisem można znaleźć w arrestowej „encyklopedii„.
Jak czytać subsety? Grafika reprezentująca dany subset korzysta z bioinformatycznej formy wizualizacji danych, określanej jako „logo”. Wielkość litery w logosie odzwierciedla częstość, z jaką dany aminokwas występuje w subsecie.
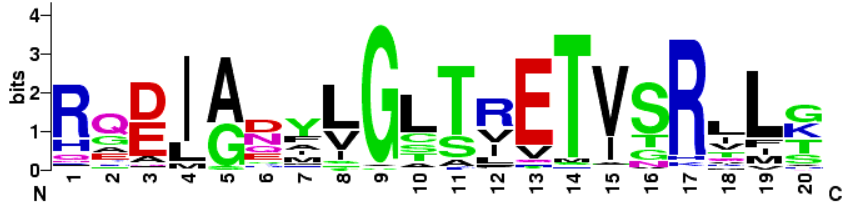
W moich własnych statystykach, opracowanych z ok. 500 przypadków CLL wynika, że wśród łańcuchów V dominują V1-69, V4-34 i V3-21 (łącznie ponad 20% wszystkich CLL), a wśród subsetów 1#, #2 i #4 (kilka % wszystkich CLL). Nigdy nie widziałam też zmutowanego łańcucha V1-69, one chyba zawsze są niezmutowane… Jest sporo teorii skąd się bierze stereotypia łańcuchów V i jak to się dzieje, że powoduje białaczkę. Póki nie ma pewności, nie będę zgadywać tylko odsyłam do literatury!
Dla tych, którzy uczą się do egzaminu specjalizacyjnego istotne będą informacje:
- IGHV jest ważnym markerem prognostycznymi i predykcyjnym.
- Trochę wbrew temu co podpowiada intuicja, zmutowane łańcuchy rokują korzystnie, a niezmutowane niekorzystnie.
- 98% identyczności to próg oddzielający IGHV zmutowane od niezmutowanych.
- Bez względu na statystyczna zmutowania, wykrycie subsetu #2 i #8 rokuje niekorzystnie.
